系边上老师的课边做的一些笔记以及自己的一些想法,但有时候可能会拖更,分享给大家,有不妥之处,敬请评论区指正。
气体动理论总结(持续更新中…)
一、基本概念、微观结构、统计规律
1、热力学系统与外界
- 热力学系统:一般相对较大、能被察觉,包含大量的分子原子。
- 外界:系统之外(严谨的废话)。
2、物质的微观结构
- 宏观的物体都由大量微观粒子构成
- 所有分子都在不停无规则的热运动
- 分子间存在相互作用力
3、气体分子热运动的主要特征
- 分子间间距大
- 碰撞频繁
- 遵从牛顿运动定律(相对较低速)
4、理想气体微观模型
- 气体分子看作小球,可以弹性也可以刚性
- 分子间只有相互碰撞,没有其他相互作用,所以没有分子间势能
- 碰撞时分子看成完全弹性小球
5、平衡态
- 是指在系统不受外界影响时,各部分宏观性质长时间不随时间改变的状态
- 平衡态应用:热力学第三定律
6、温度
整理老师ppt的部分结束了,俺懒得copy了,接下来就是一些理论的推导过程以及我觉得重要的地方
理想气体平衡态时宏观描述
注意表述,有哪些定语,理想气体、平衡态、宏观
- 有V(体积)、P(压强)、T(温度)、M(质量)、、、气体的宏观量,并且有由它们相互之间构成的关系——克拉伯龙方程
- 还有许多由实验得来的定律,等温的玻意尔定律,等容的查理定律,等压的盖吕萨克定律都可以在克拉伯龙方程得到体现,相信大家高中学的都挺好,这些不在话下。
$PV= \nu RT$ ($\nu$为摩尔数,T单位为开尔文K)
它有许多变式
$\because \nu=\frac{m}{M}=\frac{N}{N_A}$
$\therefore \dotsb$
$\because k = \frac{R}{N_A}$(k为玻尔兹曼常数)
$\because n=\frac{N}{V} = \frac{\nu N_A}{V}$ (n为分子数密度)
$\therefore 它又能写成 PV=NkT, P=nkT$
其中常数$R=8.314510J/molK$
$k=1.380658 \times 10^{-23} J/K$
理想气体压强公式
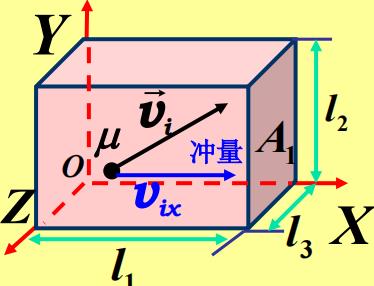
- 首先得清楚,压强的来源是每一个小分子对于器壁都会有冲击力,但是这里的P是大量分子撞击的宏观结果,单个的分子无法讨论压强。
- 下面开始推导
在一个边长分别为$l_1,l_2,l_3$的全反射壁容器内
分子碰撞基本理论——平均自由程
Maxwell速率分布
温度公式
温度与平动动能有关,相同温度不同气体,平动动能一定相等,但总动能和内能不一定相等
阿佛加德罗定律
道尔顿分压定理
能量均分定理
气体内能的讨论
Maxwell速率分布
最可几/最概然 速率 无序度增加